一言でいうと:がん細胞だけを目印に“狙い撃ち”し、そこに届いたときだけ強力な薬を放す「宅配便型」の抗がん剤です。
目次
- ADCの超ざっくり要点
- どんな仕組みで効くの?
- 3つの基本パーツ
- メリットと注意点
- 検査(バイオマーカー)の話
- 代表的な“標的”の例
- よくある質問(Q&A)
- 医師に聞くとよい質問リスト
- もう少し深く:やさしい技術用語解説
- 誤解されやすいポイント
- 関連リンク・参考情報
- サイト運営上の注意(免責)
ADCの超ざっくり要点
- 標的(目印)を見分ける抗体に、とても強い薬(ペイロード)をはずれる工夫(リンカー)で結んだお薬。
- からだ全体への無差別攻撃を減らし、がんのある場所でだけ薬を放すことを目指します。
- とはいえ副作用ゼロではありません。標的が少しある正常細胞や、放出された薬が周囲に及ぶことで影響が出ることがあります。
仕組みをイメージ
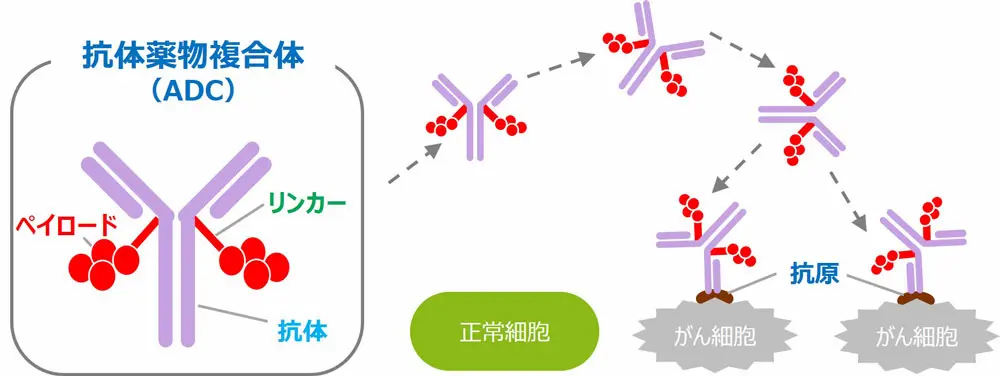
どんな仕組みで効くの?
- 標的を認識:抗体が、がん細胞の表面にある特定のたんぱく質(抗原)を見つけて結合。
- 細胞に取り込まれる:くっついたADCごと細胞内に入ります(内部化)。
- 薬が放出:細胞内の環境(酸性度や酵素など)でリンカーが切れて、強力な薬が出ます。
- がん細胞を壊す:放出された薬が、細胞の増殖に必要な仕組み(DNAや微小管など)を止めます。
例えると、宛名(標的)つき小包(抗体)の中に強い薬が入っており、相手先の家の中(細胞内)でだけ開封されるイメージです。
3つの基本パーツ
1) 抗体(Antibody)
- 「どこへ届けるか」を決める案内役。
- がん細胞に多い目印(抗原)を狙います。
2) リンカー(Linker)
- 抗体と薬をつなぐ鎖。決まった条件になると外れます。
- 例:酸に弱い/酵素で切れる/還元で切れるなど。
- 外れやすさ・外れにくさのバランス設計がとても重要です。
3) 薬(ペイロード, Payload)
- 非常に強力につくられた抗がん薬。少量でも作用します。
- 代表的なタイプ:
- 微小管阻害(例:MMAE/MMAFなど)
- トポイソメラーゼ阻害(例:SN-38など)
- DNAに結合して壊すタイプ(例:PBD誘導体 など)
補足:DAR(Drug-to-Antibody Ratio)は「抗体1個に薬が何個ついているか」の目安。高すぎても低すぎても思わしくないため、適切な値に設計されます。
メリットと注意点
メリット
- 狙い撃ち効果:標的が多い細胞に集まりやすい。
- 少量で強く:ペイロードが非常に強力なので、がんの中で効率よく作用。
- 既存治療との使い分け:化学療法・分子標的薬・免疫療法と順番や組み合わせを検討できます(適応による)。
注意点(副作用など)
- 副作用ゼロではない:吐き気、疲労感、骨髄抑制(血球減少)などが出ることがあります。
- 薬が周囲に及ぶ(バイスタンダー効果):設計上メリットもありますが、正常細胞への影響につながることも。
- 臓器特有の副作用:薬のタイプにより肺、肝臓、目、神経などに注意が必要なものがあります。
- 検査が鍵:標的が少ないと効きにくい場合があり、治療前にバイオマーカー検査が行われます。
どんな副作用が起きやすいかは薬の種類や患者さんの状態で異なります。自覚症状の変化は早めに医療者へ。
検査(バイオマーカー)の話
- ADCは「どの目印を狙うか」が決まっています。治療前に病理検査などで、目印(標的抗原)の有無や量を確認します。
- 標的がたくさんある方が効きやすい傾向ですが、低発現でも使える薬があるなど、薬ごとに違いがあります。
- 例:HER2、TROP2、Nectin-4、CD30など(薬剤・がん種により異なる)。
代表的な“標的”の例
注:国や時期で適応が異なります。具体的な薬剤名・対象がんは主治医の説明や公的情報でご確認ください。
- HER2:乳がん、胃がん など
- TROP2:乳がん、膀胱がん、非小細胞肺がん など
- Nectin-4:尿路上皮がん など
- CD30:ホジキンリンパ腫 など
よくある質問(Q&A)
Q1. 従来の抗がん剤と何が違いますか?
- 従来薬は全身に広く作用しやすいのに対し、ADCは標的に届いてから薬を放す設計。狙い撃ちを目指しています。
Q2. 免疫療法や「抗体薬」とは違うの?
- 従来の抗体薬は、抗体そのものの働き(免疫を呼び込む等)で効きます。ADCは抗体+強い薬をリンカーで結んだ複合体です。
Q3. 副作用は軽いの?
- 軽くなるとは限りません。種類によっては骨髄抑制や肺・肝・目・神経の副作用に注意が必要です。早めの相談が何より大切です。
Q4. どのがんにも使えるの?
- 標的があるがんで使われます。標的が少ない/ない場合は適さないことがあります。
Q5. 検査は痛い?時間は?
- 腫瘍の組織や細胞を調べる病理検査や、血液・画像検査などが必要になることがあります。詳細は担当施設により異なります。
医師に聞くとよい質問リスト
- 私のがんに標的(目印)はありますか? その検査結果は?
- このADCの目的(治癒・延命・症状緩和など)は?
- 期待される効果の目安と副作用は?
- 他の選択肢(化学療法、分子標的薬、免疫療法)との違いは?
- 治療スケジュール(点滴の頻度・期間)は?
- 注意すべき症状(いつ受診/連絡するか)は?
- 仕事・家事・旅行など日常生活への影響は?
もう少し深く:やさしい技術用語解説
- 内部化(エンドサイトーシス):抗体が結合した細胞が、それを袋のように包み込んで内部に取り込むこと。
- リンカーの種類:
- 切れやすいリンカー(酸・酵素・還元などで切断):がん細胞内で薬を放しやすい。
- 切れにくいリンカー:安定性が高く、狙った場所で外す設計に使われます。
- バイスタンダー効果:放出された薬が近くの細胞にも広がること。がんのばらつきに有利な面と、正常細胞への影響の面があります。
- DAR:抗体1個に結合する薬の数(例:DAR=8なら薬8個)。効果と安全性のバランスをとる設計指標です。
- ペイロードの例:
- MMAE/MMAF(微小管阻害)
- DM1/DM4(微小管阻害)
- SN-38(トポイソメラーゼI阻害)
- PBD誘導体(DNA架橋)
誤解されやすいポイント
- 「副作用がない」わけではない:設計は“狙い撃ち”でも、影響が全くないとは限りません。
- 「標的が少なくても必ず効く」わけではない:薬ごとに条件があり、検査で確認が必要です。
- 「検査結果は永遠に同じ」ではない:がんは性質が変わることがあります。再検査が必要になる場合があります。
関連リンク・参考情報
- 国や地域、時期によって承認状況や適応が異なります。具体的な薬剤名・最新情報は、主治医・病院の資料・公的機関のサイトをご確認ください。
- 臨床試験情報は、Trial Compass内の各NCTページも参考にしてください(例:対象がん種や標的の一致をチェック)。
免責事項
- 本ページは一般向け解説で、治療の選択は主治医との相談を前提とします。
- 薬剤名・適応・用法用量・副作用情報は更新されます。最新の添付文書、公的情報、医療者の指示に従ってください。